Зміст
- Кількість електронів у валентній оболонці
- Крок 1
- Крок 2
- Крок 3
- Крок 4
- Структура Льюїса
- Крок 1
- Крок 2
- Крок 3
- Формальний заряд кожного атома
- Крок 1
- Крок 2
- Крок 3
Визначаючи формальний заряд такої молекули, як CoCl2 (газ фосген), необхідно знати кількість електронів у валентному шарі кожного атома та структуру молекули Льюїса.
Кількість електронів у валентній оболонці
Крок 1
Шукайте кожен атом у періодичній системі елементів, щоб визначити кількість електронів у валентній оболонці.
Крок 2
Пам'ятайте, що два електрони знаходяться на першому підрівні s, два знаходяться на другому підрівні s, шість електронів на першому підрівні p тощо. Запам’ятайте: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
Крок 3
Вдарте вантаж. Якщо молекула є іоном, додайте або відніміть один або декілька електронів від загальної суми, щоб дійти до кінцевого заряду.
Крок 4
Для CoCl2 (газ-фосген): C = 4; O = 6; Cl = 7. Молекула не іонізована і має нейтральний заряд. Отже, загальна кількість електронів у валентній оболонці дорівнює 4 + 6 + (7x2) = 24.
Структура Льюїса
Крок 1
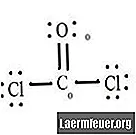
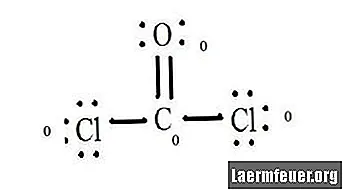
Див. Схему структури Льюїса CoCl2 (газ фосген). Структура Льюїса являє собою найбільш стабільну і ймовірну структуру для молекули. Атоми тягнуться парними валентними електронами; між вільними електронами утворюються зв’язки, щоб задовольнити правило октету.
Крок 2

Намалюйте кожен атом та його валентні електрони, а потім утворюйте зв’язки за потреби.
Крок 3
Атоми хлориду мають прості зв’язки з молекулою вуглецю, тоді як атом кисню утворює подвійний зв’язок з вуглецем. Кожен атом у кінцевій структурі задовольняє правилу октету і має вісім електронів у валентній оболонці, що забезпечує молекулярну стабільність.
Формальний заряд кожного атома
Крок 1
Порахуйте безелектронні пари кожного атома в структурі Льюїса. Кожному атому присвоюється електрон від кожного зв’язку, в якому він бере участь. Додайте ці цифри. У CoCl2: C = 0 вільних пар плюс 4 електрони зв’язків = 4 електрони. O = 4 електрони вільних пар плюс 2 електрони зв’язків = 6 електронів. Cl = 6 електронів вільних пар плюс один електрон зв'язку з C = 7 електронами.
Крок 2
Відніміть кількість кількості електронів у валентній оболонці у незв’язаному атомі. Результатом є формальний заряд для кожного атома. У CoCl2: C = 4 валентних електрона (ev) у незв'язаному атомі мінус 4 електрони, позначені в структурі Льюїса (LS) = 0 формальний заряд O = 6 ev - 6 LS = 0 формальний заряд Cl = 7 ev - 7 LS = 0 офіційний вантаж
Крок 3
Під час письма розмістіть ці заряди близько до атомів у структурі Льюїса. Якщо молекула має загальний заряд, розмістіть структуру Льюїса в дужках, а заряд напишіть зовні у правому верхньому куті.